CONTOH SOAL 1
Hitung potensial titik ekivalen suatu elektroda platina terhadap elektrode kalomel jenuh dalam titrasi Fe2+ terhadap Cr2O72- dalam larutan asam 1,0 M Fe3+ + e Fe2+ dan E0 = 0,74 V.
Cr2O72- + 14H- + 6e → 2Cr3+ + 7H2O dan E0 = 1,00 V.
Jawaban
Reaksi oksidasi Fe2+ menjadi Fe2+ dengan koefisien stoikiometri yang benar adalah
Cr2O72- + 14H- + 6Fe2+ → 6Fe3+ + 2Cr3+ + 7H2O
kondisi awal | 6a | - | - | - |
penambahan pada titik ekivalen | - | a | - | - |
kondisi kesetimbangan | (6a-6x) | (a-x) | 6x | 2x |
Dengan demikian, pada titik ekivalen
dan
Eek terhadap EHS =  ………persamaan A
………persamaan A
Dan
Jika H+ = 1, maka
6 x Eek terhadap EHS =  ………..persamaan B
………..persamaan B
penjumlahan persamaan A dan B akan menghasilkan
sehingga
Eek terhadap EHS = 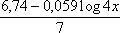 ………persamaan C
………persamaan C
Dalam persamaan C suku-suku log tidak saling menghilangkan. Meskipun demikian, pada tingkat konsentrasi yang biasanya digunakan uuntuk titrimetri, suku loag (4x) biasanya kecil dan dapat diabaikan. Sehingga
Dan jika pada potensial elektrode kalomel jenuh terhadap elektrode hidrogen standar adalah +0,24 V, maka
Eek terhadap EKJ = (0,96-0,24)V
= 0,72 V
Catatan
1. Dianggap bahwa spesies yang ada dalam larutan 1,0 M hanyalah Cr3+ dan Cr2O72- . konsentrasi spesies-spesies lain seperti HCrO4- dianggap sangat kecil dan dapat diabaikan
2. Elektroda platina inert dianggap memberi tanggapan secara reversibel terhadap nisbah konsentrasi [Cr3+ ] / [Cr2O72- ] dan terhadap nisbah konsentrasi [Fe2+ ] / [Fe3+ ]. Akan tetrapi, pada kebanyakan titrasi redoks elektrode inert mempunyai potensial campuran sehingga kurva titrasi eksperimental dan kurva titrasi hasil perhitungan tidak identik.





Tidak ada komentar:
Posting Komentar